Introducción:
En el siguiente blog van a ver como las
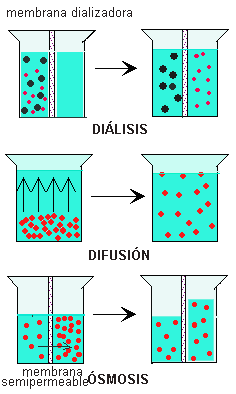
membranas celulares y algunos productos sintéticos (como el celofán), son
semipermeables. Esto sucede cuando están en contacto con una disolución, que
solo permite el paso de algunas sustancias, moléculas, a través de sus poros. Este
proceso que están apunto de ver se denomina osmosis, que es del griego osmos =
impulso. Para entenderlo de mejor manera planteare los siguientes objetivos:
- Plantear preguntas con respuestas para entender mejor.
- Ver imágenes explicativas.
- Plantear en donde se utiliza la osmosis.
Es un fenómeno que consiste en el paso
selectivo de moléculas de un disolvente desde un lugar con menor concentración
a otro lugar de mayor concentración de soluto, a través de una membrana porosa
y semipermeable, es decir, una membrana que solo deja pasar algunas moléculas
del disolventes. Estas características se presentan en membranas biológicas,
membranas de diálisis y un tipo de papel celofán (polímero derivado de la
celulosa).
¿Cómo funciona la
Osmosis?
Lo utilizan las células vivas para que
se produzca el flujo neto de material entre ellas y el medio circulante, lo que
les permite cumplir sus funciones vitales. Cuando una célula se encuentra en un
medio constituido por una disolución de menor concentración que la del interior
de la célula, liquido hipotónico, se produce el paso de moléculas de agua hacia
el interior de la célula a través de su membrana, de modo que la célula se
hincha. Por lo contrario, es decir, cuando el medio exterior tiene mayor concentración
que el interior de la célula, liquido hipertónico, entonces las moléculas de
agua pasan de la célula al exterior a través de su membrana y la célula se
contrae. Y cuando la célula se encuentra en ele seno de la disolución, hay una
igualdad, es decir, cuya concentración es la misma que la del interior de la
célula, no se produce cambio neto en el paso de moléculas de agua, se dice que
ese liquido es isotónico o isosmótico respecto de la célula.
- En la Medicina: Se utiliza la osmosis a través de diálisis corresponde al proceso artificial de filtración de los productos de desecho y la eliminación de los líquidos en exceso en el organismo cuando los riñones no efectuarlo normalmente. Este procedimiento suele utilizarse en pacientes que padecen de insuficiencia renal, pero también se aplica para mover de forma rápida sustancias tóxicas en complejas situaciones.
Presión osmótica:
Es
el valor que alcanza la presión hidrostática de la disolución originalmente mas
concentrada en el momento en que se interrumpe el paso de moléculas de agua
hacia su seno. Se entiende como aquella que establece el equilibrio dinámica,
entre el paso de disolvente desde la disolución diluida hacia la mas
concentrada y viceversa. Al igual que la elevación del punto de ebullición y la
disminución del punto de congelación, la presión osmótica es directamente
proporcional a la concentración de la disolución y es independiente de la
naturaleza del soluto, como son todas las propiedades coligativas. La presión osmótica
se representa, según la siguiente ecuación:
“c” o “M” = concentración
molar de la disolución.
“R” = constante de
los gases (0,082L atom· mol· K).
“T”= temperatura en
Kº.
Osmosis inversa:
Osmosis inversa:
Se puede decir que
se está haciendo lo contrario de la ósmosis, por eso se llama ósmosis inversa.
Téngase en cuenta que en la ósmosis inversa a través de la membrana
semipermeable sólo pasa agua. Es decir, el agua de la zona de alta
concentración pasa a la de baja concentración.
Si la alta
concentración es de sal, por ejemplo agua marina, al aplicar presión, el agua
del mar pasa al otro lado de la membrana. Sólo el agua, no la sal. Es decir, el
agua se ha desalinizado por ósmosis inversa, y puede llegar a ser potable.
Marco Conceptual:
- Disolvente: son moléculas que se encargan de disolver otras, conocido como soluto, por lo general están en estado físico liquido.
- Concentración: Magnitud que
expresa la cantidad de una sustancia por unidad de volumen. Su unidad en el
Sistema Internacional es el mol por metro cúbico(mol/m3).
- soluto: conjunto de moleculas que se disuelven en un solvente.
- disolucion: mezclas de un soluto y un disolvente.
- membrana:Placa o lámina de pequeño espesor, generalmente flexible.
- semipermeable: que deja que se moje poco, en este caso es una membrana selectiva.
- hipotónico: Que tiene menor presión osmótica que otra con la que se compara.
- hipertónico: Que tiene mayor presión osmótica que otra con la que se compara.
- isotónico o isosmotico: Que tiene igual presión osmótica que otra con la que se compara.
- diálisis: es la difunción de soluto a través de una membrana semipermeable que separa dos disoluciones de distinta concentración y cuyo desplazamiento se afectuá a favor del gradiente de concentración.
- gradiente: Razón entre la
variación del valor de una magnitud en dos puntos próximos y la distancia que
los separa
- molar: unidad de medida para ser utilizada en calcular la concentración molar de una disolución.
- propiedades coligativas:
- punto de congelación: es el punto de temperatura donde se congelan las moléculas.
- punto de ebullición: es el punto de temperatura donde se evaporan las moléculas.
- potable: que se puede beber.
- moléculas: Unidad mínima de
una sustancia que conserva sus propiedades químicas. Puede estar formada por
átomos iguales o diferentes.
Conclusión:
Este blog tubo finalidad de informar y aclarar dudas sobre ósmosis sus funciones, como se utiliza. Se cumple los objetivos planteados en la introducción también se aprende como funciona una diálisis esto sirve para combatir la ignorancia de algunas personas. Entonces la ósmosis es el paso de moléculas a través de una membrana porosa semipermeable, para obtener una igualdad entre las distintas disoluciones en que se encuentra la membrana. Este proceso es utilizado por la naturaleza en las células, y también en tratamientos como en diálisis.
Anexo:
Bibliografia:
- texto para el estudiante, química 2 º medio, 2007-2008, editorial mare nostrum ltda.
- texto para el estudiante, química 2 º medio,2009, editorial cal y canto.
- texto para el estudiante, química 2 º medio, 2012, editorial santillana.
- youtube
- http://www.rae.es









Está muy ordenada la información dentro del blog, a mi parecer los colores de fondo no son muy atractivos, pero las letras son agradables para leer, buen blog.
ResponderEliminarmuy buen trabajo pero yo creo que debiste poner mas información , pero esta muy bien , y el fondo combina con el tema , y tambien debiste colocar mas imagenes
ResponderEliminarMaria jose olivares araya
Excelente orden, información completísima y fácil de leer y entender, su estética es muy buena :)
ResponderEliminar-Marco Bettancourt G.
buen blog, las imagenes estan bien seleccionadas, las letras que estan un poco pequeñas y una breve introduccion, pero en lo demas esta bien
ResponderEliminar